基因编辑是一种对基因组特定位点进行修饰的基因工程技术,迄今为止基因编辑技术已经在动植物和微生物的基因组研究中得到了广泛的应用。
DNA双链的断裂可以提高基因编辑的效率,当DNA双链断裂时细胞会开启非同源末端连接(NHEJ)修复途径或同源重组(HDR)修复途径来修复受损伤的DNA,当没有修复模板时DNA以NHEJ途径快速修复DNA,而NHEJ容易出错的特性经常导致基因的失活突变;当有修复模板时细胞可以启动HDR途径,从而实现精准的基因编辑。所以推动基因编辑发展的关键是可以产生位点特异性双链断裂的工程核酸酶的发现。这些工程核酸酶主要包括锌指核酸酶(ZFNs)、转录激活子样(TAL)效应物核酸酶(TALENs)和CRISPR/CAS9核酸酶。
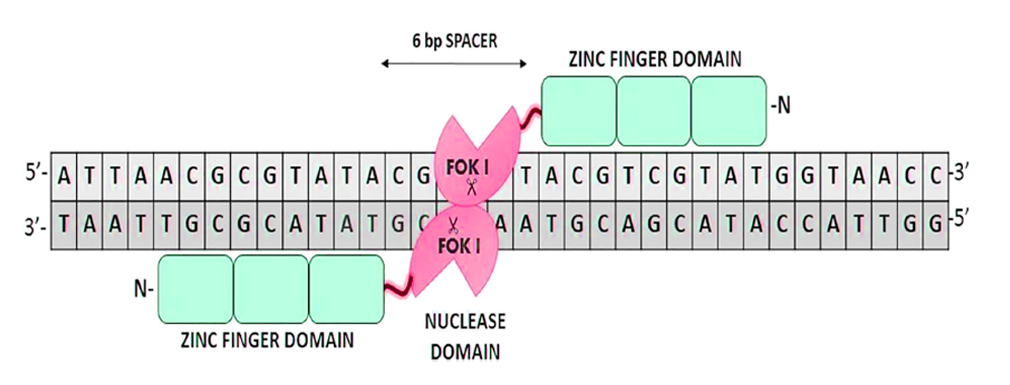
锌指核酸酶(ZFNs):该核酸酶的发现代表着精准基因编辑的开始,它由DNA识别结构域和非特异性核酸内切酶结构域组成。其中DAN识别结构域由3个锌指结构串联组成,每个锌指结构约含30个氨基酸,被1个锌离子所固定,可识别并结合1个特异的三联体碱基。核酸内切酶结构域是来自FokI限制性核酸内切酶,只在二聚体状态时才有酶切活性,每个FokI单体与一个锌指蛋白组相连构成一个锌指核酸酶,识别特定的位点,当两个识别位点相距恰当的距离时(6~8 bp),两个单体锌指核酸酶相互作用产生酶切功能,从而达到 DNA 定点剪切的目的。
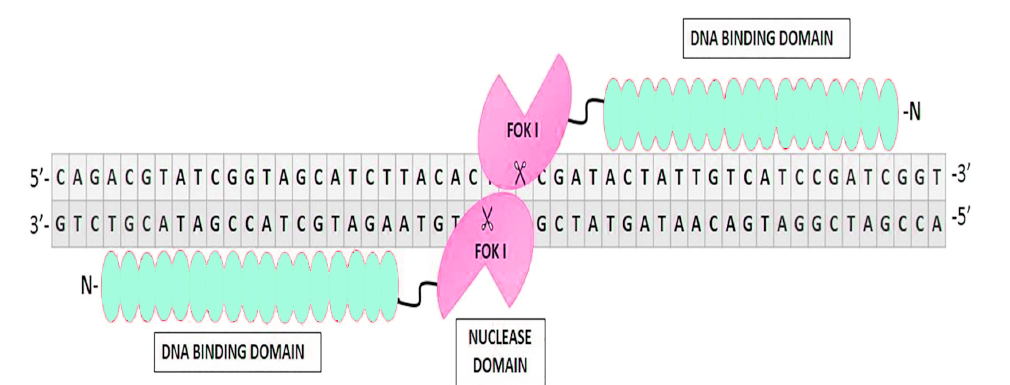
转录激活子样(TAL)效应物核酸酶(TALENs):该核酸酶在2011年首次被报道,是基因编辑技术的重大进步。TALENs与ZFNs有很多相似的地方,也是由DNA识别结构域和核酸内切酶结构域组成,并且也是在二聚体的状态下对DNA进行双链切割。与ZFNs最大的区别在于DNA结构域的组成。TALENs的DNA结构域主要由转录激活子样效应物(TALE)串联组成,每个TALE结构可以特异性的识别一种碱基,特异性靶序列的长度通常在30-40bp。相对ZFNs而言,TALEN能够靶向更长的基因序列,而且也更容易构建。
ZFNs和TALENs虽然在基因编辑扮演了重要的角色,但是由于效率不高,设计复杂,操作困难,价格昂贵所以它们的应用受到了限制,CRISPR/CAS9系统的出现很大程度上弥补了以上两种基因编辑工具的缺陷。
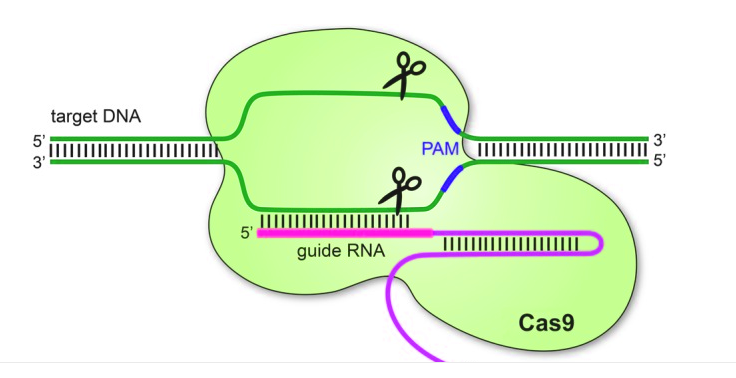
CRISPR/CAS9核酸酶: CRISPR(Clustered Regularly Interspaced Short Palindromic Repeat)/CAS9系统由两个组成部分,第一部分为一个匹配目标基因的向导RNA,它可以引导Cas9蛋白到目标DNA区域;第二部分为Cas9 (CRISPR-associated protein 9)核酸内切酶,它可以引起靶位点的双链DNA断裂,结构如下图。CRISPR系统在2013被《科学》杂志列为年度十大科技进展之一,它有着简单、可靠、经济、高效的优点,它的出现使基因编辑进入了黄金时代。